市一模试卷
发布时间:2018/10/17 8:10:01 作者:马明祥 浏览量:1101次
![]()

可能用到的相对原子质量:H 1 N 14 O 16 S 32 Mn 55 Ba137
选择题
单项选择题:本题包括10小题,每小题2 分,共计20 分。每小题只有一个选项符合题意。
1、 第三届联合国环境大会的主题为“迈向无污染的地球”。下列做法不应提倡的是
A.推广电动汽车,践行绿色交通
B.改变生活方式,预防废物生成
C.回收电子垃圾,集中填埋处理
D.弘扬生态文化,建设绿水青山
2、冰晶石可由Al(OH)3、NaCl、CaF2及H2SO4等原料生产。有关化学用语表示错误的是
![]() A.冰晶石的化学式: Na3AlF5 B.中子数为13的铝原子:
A.冰晶石的化学式: Na3AlF5 B.中子数为13的铝原子: ![]() Al
Al
C.氯离子的结构示意图: D.CaF2的电子式:![]()
3、下列有关物质性质与用途具有对应关系的是
A.MnO2不溶于水,可用作H2O2分解的催化剂
B.SO2具有漂白性,可用于制溴工业中吸收Br2
C.FeCl3溶液显酸性,可用于蚀刻铜制的电路板
D.NH4NO3分解产生大量气体,可用作汽车安全气囊产气药
4、一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。
已知:
| Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
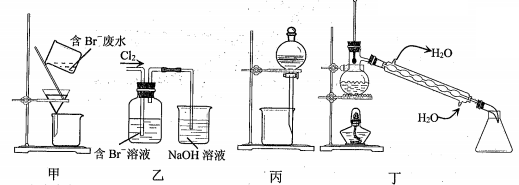
下列说法正确的是
A.用甲装置过滤时,需不断搅拌
B.用乙装置将Br-氧化为Br2
C.丙装置中用正十二烷而不用CCl4,是因为其密度小
D.可用装置丁进行蒸馏,先收集正十二烷再收集Br2
5、短周期主族元素X、Y、Z、W原子序数依次增大,X、W同主族,Y的原子半径是所有短周期主族元素中最大的,Z是地壳中含量最多的金属元素,四种元素原子的最外层电子数总和为16。下列说法正确的是
A.原子斗径:r(X)<r(Z)><r(W)
B.简单氢化物的热稳定性:X<W
C.Y、Z、W的最高价氧化物的水化物两两之间均能反应
D.X 分别与Y、W形成的化合物中所含化学键类型相同
6、下列指定反应的离子方程式正确的是
A.NO2通入水中: 3NO2+H2O=2H++2NO2 -+NO
B.Fe(OH)3溶于HI 溶液: Fe(OH)3+3H+=Fe3++3H2O
C.(NH4)2SO4溶液中加入Ba(OH)2 溶液: NH4+ +SO![]() +Ba2++OH-=BaSO4↓
+Ba2++OH-=BaSO4↓
D.向NaAlO2溶液中滴入NaHCO3溶液产生白色沉淀:AlO2-+HCO3-+H2O=Al(OH)3 ↓+CO![]()
7、在给定条件下,下列选项所示的物质间转化均能实现的是
8、常温下,下列各组离子在指定溶液中能大量共存的是
A.无色透明溶液中: Ca2+、Cu2+、Br-、Cl-
B.能使酚酞变红的溶液中: K+、Na+、CO![]() 、AlO2-
、AlO2-
C.c(ClO-)=1mol·L-1的溶液中:Fe2+、Al3+、NO3-、I-
D. ![]() =0.1mol·L-1的溶液中: NH4+、Mg2+、SO42-、CH3COO-
=0.1mol·L-1的溶液中: NH4+、Mg2+、SO42-、CH3COO-
9、已知: 4FeO42- +10H2O=4Fe(OH)3↓+8OH-+3O2↑ ,测得c(FeO42- )在不同条件下变化如图甲、乙、丙、丁所示:
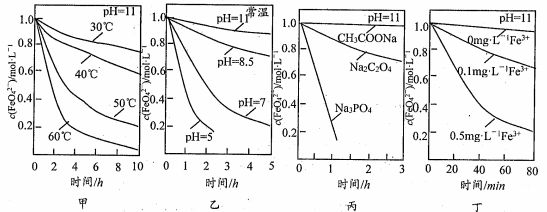
下列说法正确的是
A.图甲表明,其他条件相同时,温度越低FeO42-转化速率越快
B.图乙表明,其他条件相同时,碱性越强FeO42-转化速率越快
C.图丙表明,其他条件相同时,钠盐都是FeO42-优良的稳定剂
D.图丁表明,其他条件相同时,碱性条件下Fe3+能加快FeO42-的转化
10、一种生物电化学方法脱除水体中NH4+的原理如下图所示:
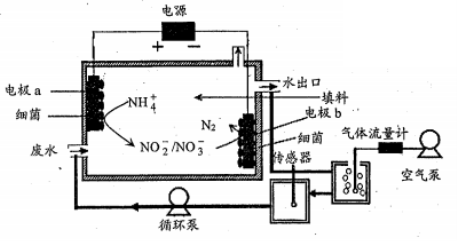
下列说法正确的是
A.装置工作时,化学能转变为电能
B.装置工作时,a极周围溶液pH 降低
C.装置内工作温度越高,NH4+脱除率一定越大
D.电极b 上发生的反应之一是: 2NO3--2e-=N2↑+3O2↑
不定项选择题:本题包括5 小题,每小题4 分,共计20 分。每小题只有一个或两个选项符
合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,
只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11、黄檀内酯是一种具有抗肿瘤、抗菌、抗氧化等生物活性的天然化合物,可由香兰素为
原料合成(如下图所示)。
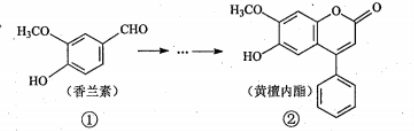
下列说法正确的是
A.①、②分子中碳原子一定都处于同一平面
B. ①、②均能使酸性KMnO4溶液褪色
C.化合物①能与NaHCO3反应产生CO2
D.1mol化合物②最多只能与2molNaOH反应
12、下列说法正确的是
A.用牺牲阳极阴极保护钢铁水闸时,将钢铁水闸与石墨相连
B.22.4L(标准状况)O2与1molNa充分反应,转移电子数为2×6.02×1025
C.反应3Si(s)+2N2(g)=Si3N4(s)能自发进行,则该反应的△H<0
D.由反应CO(g) +H2O(g)= CO2 (g) +H2 (g) △H1,CH4(g) +H2O(g)= CO (g) +3H2 (g) △H2,
则反应CH4(g) + CO2 (g) = 2CO (g) +2H2 (g) 的△H=△H2—△H1
13、根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向酸性含碘废水中加入淀粉溶液,然后滴入少量Na2SO3溶液,废水立刻变蓝色 | 该废水中可能含IO3- |
B | 向Fe(NO3) 3 溶液中加入铁粉,充分报荡,再滴加少量盐酸酸化后,滴入1滴KSCN溶液,溶液变红 | 原Fe(NO3)3 只有部分被Fe还原 |
C | 向1-溴丙烷中加入KOH溶液,加热并充分振荡,然后取少最液体滴入AgNO3溶液,出现棕黑色沉淀 | 1-溴丙烷中混有杂质 |
D | 将乙醇与浓硫酸混合溶液加热,产生的气体直接通入酸性KMnO4溶液,溶液紫色逐渐褪去 | 产生的气体一定是乙烯 |
14、已知:25℃时H2C2O4 的pKa1=1.22,pK a2=4.19,CH3COOH 的pK a=4.76 (电离常数K的负对数-1gK=pK)。下列说法正确的是
A.浓度均为0.1mol·L-1NH4HC2O4和CH3COONH4溶液中:c(NH4+)前者小于后者
B.0.1 mol·L-1KHC2 O 4溶液滴加氨水至中性: (NH4+)<c(C2O4 2-)
C.0.1 mol·L-1K2C2O4溶液滴加盐酸至pH=1.22: C(H+)-c(OH-)=c(Cl-)-3c(HC2O4-)
D.0.1 mol·L-1CH3COONa 溶液中滴加KHC2O4溶液至PH=4.76;c(K+)>c(Na+)>c( HC2O4 -)>c(C2O42- )>c(CH3COO-)
15、己知:CH4(g)+2H2S(g) ![]() CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4 和0.2molH2S,下图所示:
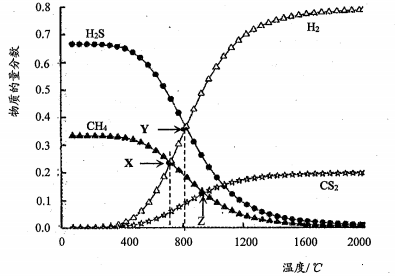
下列说法正确的是
A.该反应的△H<O
B.X 点CH4的转化率为20%
C. X点与Y点容器内压强比为51:55
D.维持Z点温度,向容器中再充入CH4、H2S、CS2、H2 各0.1mol 时V(正)<v(逆)
非选择题
16、(12分)碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]是重要的无机化工产品。一种由白云石[主要成分为CaMg(CO3)2,还含少量SiO2、Fe2O3等]为原料制备碱式碳酸镁(国家标准中CaO 的质量分数≤0.43% )的实验流程如下:
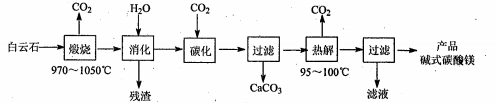
(1)“煅烧”时发生主要反应的化学方程式为_________。
(2)常温常压下“碳化”可使镁元素转化为Mg(HCO3)2,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图-1和图-2所示。
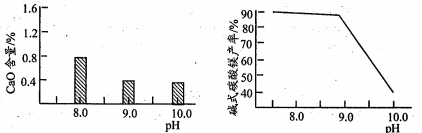
图-1CaO含量与碳化终点pH的关系 图-2碱式碳酸镁产率与碳化终点pH的关系
①应控制“碳化”终点PH 约为__________,发生的主要反应的化学方程式为___________和_________。②图-2 中,当pH= 10.0时,镁元素的主要存在形式是_____ (写化学式)。
(3)“热解”生成碱式碳酸镁的化学方程式为_____。
(4)该工艺为达到清洁生产,可以循环利用的物质是_______(写化学式)。
17、(15 分) 盐酸米多君是临床常用的升压药,其一种合成路线如下:
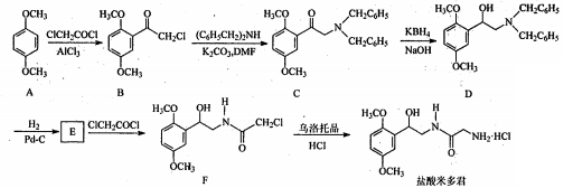
(1)盐酸米多君中含氧官能团名称为_____________ (只写两种)。
(2) B→C 的反应类型为___________。
(3)写出满足下列条件的B的一种同分异构体的结构简式:_______。
①含有苯环,分子中有一个手性碳原子,能发生银镜反应,与FeCl3溶液发生显色反应,在酸性条件下水解可生成两种有机物。
②分子中只有5 种不同化学环境的氢。
(4)E的分子式为C10H15O3N,经取代得到F。写出E 的结构简式::_______。
(5)已知: 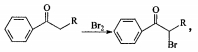 ,请写出以
,请写出以  和
和 ![]()
为原料制备 ![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
18、(12分)硫酸锰铵晶体可用作织物和木材加工的防火剂等。由二氧化锰等作原料制取硫酸锰铵晶体步骤如下:
(1)实验前,需称量MnO2的质量,这是因为________。
(2)“制取MnSO4” 时,可用C6H12O6 (葡萄糖)、H2C2O4 (草酸) 等物质作还原剂。
①用C6H12O6作还原剂(被氧化为CO2)时,发生反应的n(MnO2)/n(C6H12O6)= _______。
②用H2C2O4作还原剂,发生反应的化学方程式为_________________。
(3)一种测定硫酸锰铵晶体[设为:(NH4)xMny(SO4)2·wH2O]组成的方法如下:
①称取一定量的硫酸锰铵晶体配成250mL溶液A。
②取25.00mL 溶液A,加入足量的BaCl2溶液得BaSO40.5126g。
③另取25.00mL溶液A,加入10mL20%的中性甲醛溶液,摇匀、静置5min[4NH4++6HCHO=3H++6H2O+(CH2)6N4H+滴定时,Imol(CH2)6N4H+与ImolH+相当],加入1~2滴酚酞溶液,用 0. 100mol·L-1NaOH标准溶液滴定至终点(在该过程中Mn2+不沉淀),消耗NaOH 溶液22.00mL。
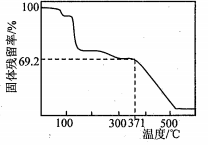
④取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%) 随温度的变化如右图所示(样品在371℃时已完全失去结晶水)。
根据以上实验数据计算确定硫酸锰铵晶体的化学式(写出计算过程)。
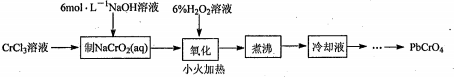
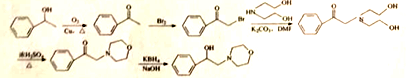
19、(15分) PbCrO4是一种黄色颜料,制备PbCrO4的一种实验步骤如下:
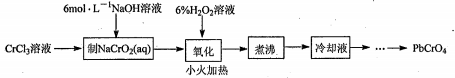
已知:
①Cr(OH)3(两性氢氧化物)呈绿色且难溶于水
②Pb(NO3)2、Pb(CH3COO)2均易溶于水,PbCrO4的Ksp为2.8×10-13,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。
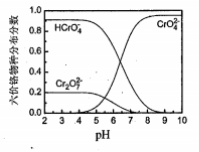
③六价铬在溶液中物种分布分数与pH关系如右图所示。
④PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成
(1)实验时需要配置100mL3mol·L-1CrCl3溶液,现有量筒、玻璃棒、烧杯,还需要玻璃仪器是______。
(2)“制NaCrO2(aq)”时,控制NaOH溶液加入量的操作方法是______。
(3)“氧化”时H2O2滴加速度不宜过快,其原因是______;“氧化”时发生反应的离子方程式为______。
(4)“煮沸”的目的是______。
(5)请设计用“冷却液”制备PbCrO4的实验方案: _______[ 实验中须使用的试剂有:6mol·L-1 的醋酸,0.5 mol·L-1 Pb(NO3)2=溶液,pH 试纸]。
20、(14 分) 硫氰酸盐、苯酚及硫代硫酸盐是HPF脱硫废液中的主要污染物(其中还含有Cl-、SO42-、Na+等),可用NaClO3、H2SO4作脱除的试剂。
(1)Cl2与热的NaOH 溶液反应生成NaClO3,该反应的化学方程式为________。
(2)常温时,反应C6H5O-+H2O![]() C6H5OH+OH -的平衡常数为K=________(C6H5OH的Ka=1×10-10) (3)处理该废水需经预处理和再处理阶段。
C6H5OH+OH -的平衡常数为K=________(C6H5OH的Ka=1×10-10) (3)处理该废水需经预处理和再处理阶段。
①用浓硫酸对600mLHPF 脱硫废液进行酸化预处理(反应温度100℃ ),其结果如表-1所示:
表-1 预处理前后三种离子浓度变化情况
项目 | S2O32-(g·L-1) | SCN-(g·L-1) | 苯酚(g·L-1) | PH |
处理前 | 34.28 | 70.11 | 1.3 | 8.55 |
处理后 | 0.91 | 69.76 | 1.35 | 2.4 |
由表-1可知,该处理过程中主要被除去的污染物是______。
②对预处理后废液进行再处理(反应温度100℃)时,分13次依次向废液中加入试剂情况如表-2所示:表-2 13 次依次加入试剂情况
次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
NaClO3/g | 16.3 | 0 | 0 | 0 | 0 | 0 | 7.6 | 0 | 5.7 | 0 | 10.9 | 0 | 7.1 |
浓H2SO4/mL | 0 | 2 | 2 | 2 | 4 | 4 | 0 | 4 | 0 | 4 | 0 | 4 | 0 |
实验结果如图-1所示
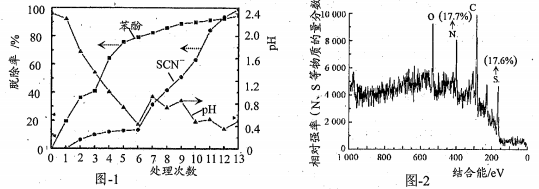
前6次苯酚脱除率可达到80%左右,该过程苯酚转化为白色沉淀(含苯环),这与溶液中ClO3-和Cl-反应产生Cl2有关,该白色沉淀可能的结构简式为_________。
③由表-2和图-1中数据得出,第7~13次操作中SCN-在较强酸性条件下被ClO3-(不水解)氧化的依据是_____________。此过程中产生大量砖红色沉淀(夹杂少量白色沉淀),对沉淀进行XPS分析,部分元素的物质的量分数如图-2所示,已知SCN-可被某些氧化剂(如Cu2+等)最终氧化为转红色沉淀(SCN)x。一种推测认为该实验中产生的砖红色沉淀为(SCN)x,支持该推测的证据有:______。
21、(12 分)【选做题】本题包括A、B两小题。请选定其中一个小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
通过反应  ,可制备有机中间体异氰酸苯酯。
,可制备有机中间体异氰酸苯酯。
(1)Ni3+基态核外电子排布式为____________。
(2)异氰酸苯酯分子中碳原了杂化轨道类型是____________,Imol 异氰酸苯酯分子中含有σ键数目为_______________。
(3)Na、O、C、N四种元素的第一电离能从大到小的顺序为_______________。
(4) C2H5OH 的沸点高于 ![]() ,这是因为_____________。
,这是因为_____________。
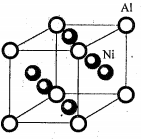
(5)Ni 与Al 形成的一种合金可用于铸造飞机发动机叶片,其晶胞结构如右图所示,该合金的化学式为___________。
B.[实验化学]
生物柴油是一种用植物油、动物油或废弃油脂等为原料加工而成的清洁燃料,主要成分为高级脂肪酸甲酯。一种用菜籽油等为原料制备生物柴油的实验步骤如下:
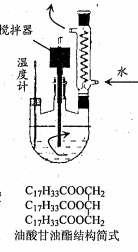
① 向右图所示的三口烧瓶中加入3.2gCH3OH、0.2gNaOH,溶解后向其中加入20g (0.021~0.023mol) 菜籽油及60mL正己烷。
② 加热至60~65℃,搅拌2.5~3h,静置。上层为生物柴油、正己烷及甲醇,下层主要为甘油。
③ 分液、水洗。
④ 蒸馏,保持120℃时至无液体流出,剩余物为生物柴油。
(1)步骤①中控制n(CH3OH)/n(油脂)>3 的目的是_________;正己烷的作用是_________。
(2) 步骤②适宜的加热方式_________;菜籽油的成分之一油酸甘油酯(结构简式如右图) 与甲醇反应的化学方程式为___________。
(3)步聚③用分液漏斗分离时,获取上层液体的方法是___________;用水洗涤上层液体时,说明已洗涤干净的依据是_______。

单项选择题:本题包括10小题,每题2分,共计20分。
1-5 CADBC 6-10 DABDB
不定项选择题:本题包括5 小题,每小题4 分,共计20 分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11.B 12.CD 13.A 14.BC 15.BD
非选择题(共80分)
16、(12分)
(1)CaMg(CO3)2![]() CaO+MgO+2CO2↑(2分)
CaO+MgO+2CO2↑(2分)
(2)①9.0(2分)
Mg(OH)2+2CO2+Mg(HCO3)2(2分) Ca(OH)2+CO2=CaCO3+H2O(2分)
③ Mg(OH)2(1分)
(3)2Mg(HCO3)2![]() 4MgCO3·Mg(OH)2+4H2O↓+6CO2↑(2分)
4MgCO3·Mg(OH)2+4H2O↓+6CO2↑(2分)
(4)CO2(1分)
17、(15分)
(1)羟基、醚键、酰胺键(2分)
(2)取代反应(2分)
(3) (3分)(4)
(3分)(4)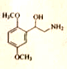 (2分)
(2分)
(5)(6分)
18、(12分)
(1)确定制备硫酸锰铵时应加入硫酸、还原剂及(NH4)2SO4的质量(2分)
(2)①12(2分) ②MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O(2分)
(3)n(SO42-)=n(BaSO4)=![]() =2.200×10-3mol(1分)
=2.200×10-3mol(1分)
n(NH4+)=n(NaOH)=0.1000mol·L-1×22.00mL×10-3L·mL-1=2.200×10-3mol (1分)
n(Mn2+)=![]() [2n(SO42-)- n(NH4+)]=1.100×10-3mol (1分)
[2n(SO42-)- n(NH4+)]=1.100×10-3mol (1分)
x:y:z=2:1:2(1分)
设化学式为(NH4)2Mn(SO4)2·WH2O
![]() =69.2% w=7 ,化学式为(NH4)2Mn(SO4)2·7H2O(2分)
=69.2% w=7 ,化学式为(NH4)2Mn(SO4)2·7H2O(2分)
19、(15 分)
(1)100mL容量瓶和胶头滴管(共2分)
(2)不断搅拌下逐滴加入NaOH溶液,至产生的绿色沉淀恰好溶解(2分)
(3)减小H2O2自身分解损失(2分) 2CrO2- +3H2O2 +2OH-=2CrO42-+4H2O (2分)
(4)除去过量的H2O2(2分)
(5)在不断搅拌下,向“冷却液”中加入6mol·L-1的醋酸至弱酸性(pH略小于7),将溶液加热至沸,先加入一滴0.5mol·LPbQNO3)2溶液搅拌片刻产生少量沉淀,然后继续滴加至有大量沉淀,静置,向上层清液中滴入Pb(NO3)2溶液,若无沉淀生成,停止滴加,静置、过滤、洗涤、干燥(5 分)
20、(14分)
(1)3Cl2+6NaOHNaClO3+5NaCl+3H2O(2分)
(2)1×10-4(2分)
(3)①S2O32-(硫代硫酸盐)(2分)
②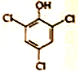 (或
(或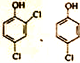 )(2分)
)(2分)
③第7、9、11、13次加入NaClO3时,pH明显增大,SCN-脱除率相应增大(或:7~13次加入NaClO3时SCN-脱除率明显增大,而苯酚脱除率增大不明显) (3分)
SCN可被某些氧化剂(如Cu2+等)氧化为砖红色的沉淀,ClO3-具有较强的氧化性,沉淀中N、S物质的量之比几乎为1∶1且还含C(3分)
21、(12分)【选做题】
A.[物质结构与性质]
(1)[Ar]3d7或1s22s22p63s23p63d7(2分)
(2)sp和sp2(2分) 14mol(2分)
(3)N>O>C>Na(2分)
(4)乙醇分子间存在氢键(2分)
(5)Ni3Al(2分)
B.[实验化学]
(1)提高酯交换时油脂的转化率(2分) 溶剂(2分)
(2)水浴加热(2分)
![]() (2分)
(2分)
(3)先分离出下层液体然后关闭活塞,从分液漏斗上口倒出上层液体(2分)
用pH试纸检验,水相呈中性(2分)
南京64,盐城68
![]()
上一篇:已是第一篇





